Química 1 Semana 8 Martes
¿Por qué es indispensable el agua para la vida?
Preguntas | ¿Porque hay la necesidad de llevar a cabo acciones que permitan la conservación del agua?. | ¿Como contribuye la química en los procesos de purificación del agua? |
Equipos | 1,2,3. | 4,5,6. |
Respuestas | Porque en un futuro se puede agotar debido a que es no renovable. Porque sencillamente si no tomas agua te mueres en dos semanas. | Que puede ser purificada mediante diversos métodos de separación como la filtración, la evaporación, la cloración, etc La química contribuye de tal forma que con los métodos de separación de mezclas podemos ir purificando el agua ☺ Ayuda en la producción de sustancias con las cuales ayuda a que el agua sea mas limpia. |
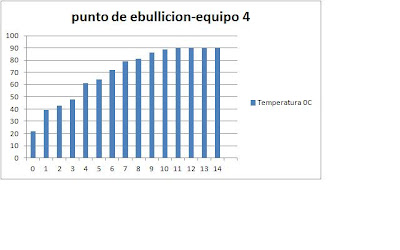
Conductividad eléctrica de los compuestos
Material: Probador de conductividad eléctrica, capsula de porcelana, lámpara de alcohol, tripie, tela de alambre con asbesto, matraz erlenmeyer 125 ml.Agitador de vidrio.
Sustancias: cloruro de sodio, sacarosa, agua solida, liquida y gaseosa.
Procedimiento:
1.- Probar la conductividad eléctrica del cloruro de sodio en seco, luego disuelto en agua.
2.- Probar la conductividad eléctrica de la sacarosa en seco, luego disuelta en agua.
3.- Probar la conductividad eléctrica del agua, solida, liquida y gaseosa.
Observaciones:
SUSTANCIAS | CONDUCTIVIDAD |
Cloruro de sodio seco no hay conductividad
Cloruro de sodio + agua la conductividad es buena
Sacarosa seca no hay conductividad
Sacarosa + agua no hay conductividad
Agua solida no hay conductividad
Agua liquida no hay conductividad
Agua gaseosa no hay conductividad
Conclusiones:
La conductividad con las sustancias asi solas no es nada buena, de hecho no hay, pero en el caso del compuesto del agua con cloruro de sodio, al ser un metal disuelto en todo el agua la conductividad si es buena.
Contribución de la Química |
Elaboración individual de un resumen, cuadro sinóptico o mapa
conceptual que sintetice lo aprendido sobre: mezcla, compuesto,
elemento, molécula, átomo, enlace y reacción química.
Revisión en grupo.
A partir de lo estudiado en la unidad, establecer en grupo las
características de los fenómenos que estudia la química.
probando la conductividad con el agua gaseosa (vapor)